Solved NCERT Questions For Class 11 Chemistry Chapter 11 In Hindi - Free PDF
In NCERT Solutions Class 11 Chemistry Chapter 11 In Hindi, you’ll dive into the world of the p-block elements. This chapter helps you understand important concepts like trends in the periodic table, properties of Boron and Carbon families, special compounds, allotropes, and more. If you ever feel stuck on tricky questions or confused about how to compare elements or write reactions, you’re not alone—Vedantu’s expert solutions are here to make things clear!
 Table of Content
Table of ContentThese NCERT Solutions break down each answer with step-by-step explanations in simple language, so you can build strong basics before your exams. It’s easy to use these solutions along with your textbook, and you can also download a free Hindi medium PDF for quick revision anytime. If you want to go through the complete syllabus, check out the Class 11 Chemistry Syllabus as well.
Studying these solutions will not only help you do better in class tests but will also boost your confidence in the CBSE board exams. Don’t forget, Vedantu’s NCERT Solutions for Class 11 Chemistry are always available in Hindi and English, making your study time smarter and easier!
NCERT Solutions for Class 11 Chemistry Chapter 5 The p-Block Elements in Hindi
1. (क) ${\mathbf{B}}$ से ${\mathbf{Ti}}$ तक तथा $\;{\mathbf{C}}$
(ख) ${\mathbf{C}}$ से $Pb$ तक की ऑक्सीकरण अवस्थाओं की भिन्नता के क्रम की व्यवस्था कीभिये !
उत्तर : ${\mathbf{B}}$ से ${\mathbf{Ti}}$ तक (बोरॉन परिवार) ऑक्सीकरण अवस्था –
बोरॉन परिवार (वर्ग 13) के तत्वों का विन्यास ns’p’ होता है। इसका तात्पर्य यह है कि बन्ध निर्माण के लिए तीन संयोजी इलेक्ट्रॉन उपलब्ध हैं। इन इलेक्ट्रॉनों का त्याग करके ये परमाणु अपने यौगिकों में $ + 3$
ऑक्सीकरण अंवस्था प्रदर्शित करते हैं। यद्यपि इन तत्वों की ऑक्सीकरण अवस्था में निम्नलिखित प्रवृत्ति प्रेक्षित होती है-
1. प्रथम दो तत्व बोरॉन तथा ऐलुमिनियम यौगिकों में केवल $+ 3$ऑक्सीकरण अवस्था प्रदर्शित करते हैं, परन्तु शेष तत्व-गैलियम, इण्डियम तथा थैलियम $+3$ऑक्सीकरण अवस्था के साथ-साथ $+ 1$ ऑक्सीकरण अवस्था भी प्रदर्शित करते हैं अर्थात् ये परिवर्ती ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं।
2. $+3$ ऑक्सीकरण अवस्था को स्थायित्व ऐलुमिनियम से आगे जाने पर घटता है तथा अन्तिम तत्व थैलियम की स्थिति में, $ + 1$ऑक्सीकरण अवस्था, $ + 3$ ऑक्सीकरण अवस्था से अधिक स्थायी होती है। इसका अर्थ यह है कि $TlCl,TlC{l_1}$से अधिक स्थायी होता है।
(ख) $c$ से $Pb$तक (कार्बन परिवार) ऑक्सीकरण अवस्था-
कार्बन परिवार (समूह 14) के तत्वों का विन्यास
$n s p$
Haemoglobin $+\mathrm{CO}_{2} \rightarrow$ Carboxyhaemoglobin
(300 times more stable than oxyhaemoglobin)
होता है। स्पष्ट है कि इन तत्वों के परमाणुओं के बाह्यतम कोश में चार इलेक्ट्रॉन होते हैं। इन तत्वों द्वारा सामान्यत: +4 तथा +2 ऑक्सीकरण अवस्था दर्शाई जाती है। कार्बन ऋणात्मक ऑक्सीकरण अवस्था भी प्रदर्शित करता है। चूंकि प्रथम चार आयनन एन्थैल्पी का योग अति उच्च होता है; अतः +4 ऑक्सीकरण अवस्था में अधिकतर यौगिक सहसंयोजक प्रकृति के होते हैं। इस समूह के गुरुतर तत्वों में $Ge\langle Sn$
1. $SnC{l_4}$ तथा $PbC{l_4}$की तुलना में $SnC{l_2}$ तथा $PbC{l_2}$अधिक सरलता से बनते हैं।
2. $PbC{l_2}$, $SnC{l_2}$से अधिक स्थायी होता है चूंकि इसमें अक्रिय युग्म प्रभाव की परिमाण अधिक होता है।
चतु: संयोजी अवस्था में अणु के केन्द्रीय परमाणु पर आठ इलेक्ट्रॉन होते हैं। इलेक्ट्रॉन परिपूर्ण अणु होने के कारण सामान्यतया इलेक्ट्रॉनग्राही या इलेक्ट्रॉनदाता स्पीशीज की अपेक्षा इनसे नहीं की जाती है। यद्यपि कार्बन अपनी सहसंयोजकता +4 का अतिक्रमण नहीं कर सकता है, परन्तु समूह के अन्य तत्व ऐसा करते हैं। यह उन तत्वों में 4-कक्षकों की उपस्थिति के कारण होता है। यही कारण है कि ऐसे तत्वों के हैलाइड जल-अपघटन के उपरान्त दाता स्पीशीज से इलेक्ट्रॉन ग्रहण करके संकुल बनाते हैं।
उदाहरणार्थ-कुछ स्पीशीज; जैसे $ - {\left( {Si{F_6}} \right)^{2 - }}$, ${\left( {GeC{l_6}} \right)^{2 - }}$ तथा -$Sn{\left( {OH} \right)^{22 - }}$ ऐसी होती हैं, जिनके केन्द्रीय परमाणु $s{p^3}{d^2}$संकरित होते हैं।
2. $TlC{l_3}$की तुलना में $BC{l_3}$ के उच्च स्थाभयत्व को आप कै से समझाएँगे ?
उत्तर:
उत्तेजित अवस्था में बोरॉन की संयोजक कोश में तीन इलेक्ट्रॉन होते हैं जो तीन Cl परमाणु से सहसंयोजक आबन्ध द्वारा जुड़कर $BC{l_3}$ अणु का निर्माण करते हैं। $BC{l_3}$ में बोरोन +3 ऑक्सीकरण अवस्था और sp संकरित अवस्था में पाया जाता है। $\rho \pi - \rho \pi $ back bonding $BC{l_3}$ अणु को आंशिक रूप से स्थायी बनाती है। दूसरी ओर अक्रिय युग्म प्रभाव के कारण $Tl$ के 6s इलेक्ट्रॉन युग्म बन्ध बनाने में रूचि नहीं रखते। इस कारण $Tl$की +1 ऑक्सीकरण अवस्था +3 ऑक्सीकरण अवस्था से अधिक स्थाई है। इसलिए +3 ऑक्सीकरण अवस्था में निर्मित $TlC{l_3}$, अधिक स्थाई नहीं होता। इस कारण $BC{l_3}$,$TlC{l_3}$ से अधिक स्थाई होता है।
3. बोरॉन ट्राइफ्लुओराइड लूइस अम्ल के समान व्यवहार क्यों प्रदर्शित करता है?
उत्तर: बोरॉन ट्राइफ्लुओराइड $B{F_3}$ अणु में $F$ परमाणुओं के इलेक्ट्रॉनों से साझा करके केन्द्रीय बोरॉन परमाणु के चारों ओर इलेक्ट्रॉनों की संख्या 6 (तीन युग्म) होती है। अत: यह एक इलेक्ट्रॉन-न्यून अणु है तथा यह स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त करने के लिए एक इलेक्ट्रॉन युग्म ग्रहण करके लूइस अम्ल के समान व्यवहार प्रदर्शित करता है।
उदाहरणार्थ-बोरॉन ट्राइफ्लुओराइड सरलतापूर्वक अमोनिया से एक एकाकी इलेक्ट्रॉन युग्म ग्रहण करके $B{F_3}.NH{}_3$ उपसहसंयोजक यौगिक बनाता है।
4. $BC{l_3}$ तथा $CC{l_4}$यौभगकों का उदाहरण देते हुए जल के प्रति इनके व्यवहार के औचित्य को समझाईए !
उत्तर: $BC{l_3}$ के केन्द्रीय परमाणु $B$ के संयोजक कोश में 6 इलेक्ट्रॉन होते हैं। इसलिए यह इलेक्ट्रॉन न्यून अणु है और ${H_2}O$ द्वारा दिये गये इलेक्ट्रॉन युग्म को ग्रहण कर लेता है। अतः जब $BC{l_3}$ को जल में घोला जाता है तो यह जल-अपघटित होकर बोरिक अम्ल और $HC{l_{}}$ देता है|
$BC{l_3} + 3{H_2}O \to H{}_3B{O_3} + 3HCl$
$CC{l_4}$ में $C$ का अष्टक पूर्ण होता है और यह इलेक्ट्रॉन युग्म त्यागने अथवा ग्रहण करने की प्रवृत्ति नहीं रखता है। अतः यह जल से कोई क्रिया नहीं करता है।
5. क्या बोरिक अम्ल प्रोटोनी अम्ल है? समझाइए।
उत्तर: नहीं, बोरिक अम्ल प्रोटोनी अम्ल नहीं है, क्योंकि यह जल में आयनित होकर ${H^ + }$ तथा $O{H^ - }$ नहीं देता है। $B$ के छोटे आकार और उसके संयोजक कोश में 6 इलेक्ट्रॉन उपस्थित होने के कारण ${H_3}B{O_3}$एक लूइस अम्ल की तरह व्यवहार करता है। जब यह जल में मिलाया जाता है। तो यह ${H_2}O$ के $O$ परमाणु से एक इलेक्ट्रॉन युग्म प्राप्त करके $\left[ {B{{\left( {OH} \right)}_{^{^{^{^{^{24 - }}}}}}}} \right]$ का निर्माण करता है।
$B{\left( {OH} \right)_3} + 2HOH \to \left[ {B{{\left( {OH} \right)}_4}} \right]$ $ + {}^ - {H_3}{O^ + }$
इस अभिक्रिया में एक ${H^ + }$ के उद्गम के कारण यह एक दुर्बल मोनोबेसिक अम्ल की भाँति व्यवहार करता है।
6. क्या होता है, जब बोरिक अम्ल को गर्म किया जाता है?
उत्तर : 370 K से अधिक ताप पर गर्म किए जाने पर बोरिक अम्ल (ऑर्थोबोरिक अम्ल) मेटाबोरिक अम्ल (HBO2) बनाता है, जो और अधिक गर्म करने पर बोरिक ऑक्साइड $\left( {{B_2}{O_3}} \right)$ में परिवर्तित हो जाता है।
${H_3}B{O_3}\xrightarrow{\vartriangle }HB{O_2}\xrightarrow{\vartriangle }{B_2}{O_3}$ ${H_3}B{O_3}\xrightarrow{\vartriangle }HB{O_2}\xrightarrow{\vartriangle }{B_2}{O_3}$
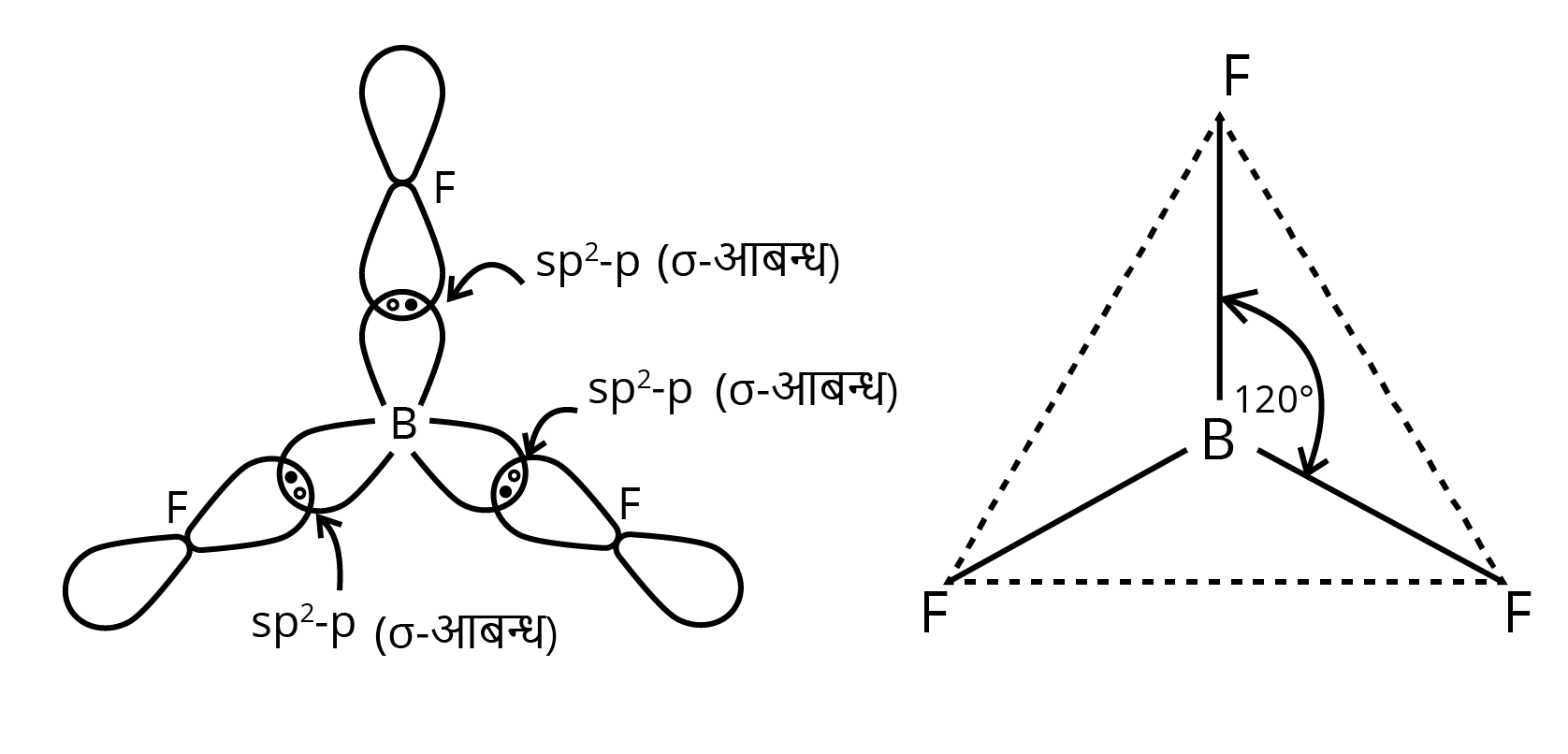
7. $B{F^3}$ तथा $B{H^{4 - }}$ की आकृति की व्याख्या कीजिए। इन स्पीशीज में बोरॉन के संकरण को निर्दिष्ट कीजिए।
उत्तर: बोरॉन ट्राइफ्लुओराइड $\left( {BFs} \right)$— इसमें केन्द्रीय परमाणु बोरॉन है। जिसका इलेक्ट्रॉनिक विन्यास $1{s^2}2{s^2}2p1$, है। तलस्थ अवस्था में इसमें केवल एक अयुग्मित इलेक्ट्रॉन है जिसके आधार पर केवल एक सहसंयोजक बन्ध ही बन सकता है। अतः $B{F^3}$अणु बनने में यह अवश्य ही उत्तेजित अवस्था में होगा जिस स्थिति में एक s-इलेक्ट्रॉन p-कक्षक में उन्नत हो जाएगा|
उत्तेजित बोरॉन में तीन अयुग्मित इलेक्ट्रॉन हैं जिससे यह तीन सहसंयोजक बन्ध बना सकता है। तीन फ्लुओरीन BF3 में युग्मन के लिए तीन इलेक्ट्रॉन प्रदान करते हैं।
इसमें एक बन्ध -इलेक्ट्रॉन के माध्यम से है तथा अन्य दो बन्ध दो p-इलेक्ट्रॉनों के माध्यम से हैं। अतः तीनों बन्ध समान नहीं होने चाहिए। s तथा px व py कक्षकों की ऊर्जा का संचय होकर तीनों कक्षकों में बराबर राशि में वितरित हो जाता है। इस प्रकार तीन sp- संकर कक्षकों का उद्भव होता है। इन कक्षकों के बीच 120° का, कोण होता है जिससे इलेक्ट्रॉन युग्मों में पारस्परिक प्रतिकर्षण न्यूनतम रहता है।
ये $\mathrm{sp}^{2-}$ संकर कक्षक F परमाणुओं के कक्षकों के साथ अतिव्यापन करके बन्ध बनाते हैं। इस प्रकार $\$ B\left\{F^{\wedge} 3\right\}$ में बन्ध कोण $120^{\circ}$ होता है तथा अणु त्रिकोणीय व समतल होता है।
चूँकि संकरण में भाग लेने वाले कक्षकों की संख्या 4 है; अत: यह $s{p^3}$ संकरण है। $s{p^3}$संकरण में एक -कक्षक तथा तीन p-कक्षकों के सम्मिश्रण से चार समतुल्य संकर कक्षक बनते हैं। इन चारों कक्षकों में अल्पतम प्रतिकर्षण होने के लिए वे एक समचतुष्फलक के चारों कोनों की ओर दिष्ट होते हैं। तथा परस्पर 109°28′ का कोण बनाते हैं। अत: $BH - 4$ की आकृति निम्नवत् होगी:-
$\left[\mathrm{BH}_{4}\right]^{-}$ की आकृति
8. ऐलुमिनियम के उभयधर्मी व्यवहार दर्शाने वाली अभिक्रियाएँ दीजिए।
उत्तर: ऐलुमिनियम अम्लों तथा क्षारों दोनों से क्रिया कर उभयधर्मी व्यवहार दर्शाता है।
उदाहरणार्थ- $2Al\left( s \right) + 6HCl\left( {aq} \right) \to 2AlC{l_3}\left( {aq} \right) + 3{H_2}\left( g \right)$
$2Al\left( s \right) + 2NaOH\left( {aq} \right) + 6H2O \to 2Na + \left[ {Al\left( {OH} \right)4} \right]$${}^ - \left( {aq} \right) + 3{H_2}\left( g \right)$
9. इलेक्ट्रॉन न्यून यौगिक क्या होते हैं? क्या $BC{l_{3\,\,}}$ तथा $SiC{l_4}$ इलेक्ट्रॉन न्यून यौगिक हैं? समझाइए।
उत्तर: जिन स्पीशीज में केन्द्रीय परमाणु का अष्टक पूर्ण नहीं होता (अर्थात् संयोजक कोश में आठ इलेक्ट्रॉन नहीं होते), वे इलेक्ट्रॉन न्यून यौगिक कहलाते हैं।
$BC{l_{3\,\,}}$के केन्द्रीय परमाणु में मात्र 6 इलेक्ट्रॉन हैं। इसलिए यह इलेक्ट्रॉन न्यून यौगिक है। $SiC{l_4}$ में । केन्द्रीय परमाणु $Si$ (silicon) के पास 8 इलेक्ट्रॉन हैं। इसलिए उपर्युक्त परिभाषा के अनुसार यह इलेक्ट्रॉन न्यून यौगिक नहीं है।
10. $C{O^2}{^ - _3}$ तथा $\,HC{O^{ - 3}}$ की अनुनादी संरचनाएँ लिखिए।
उत्तर: $C{O^2}{^ - _3}$ आयन की अनुनाद संरचनाएँ-
$\,HC{O^{ - 3}}$ की अनुनाद संरचनाएँ-
11. (क) $C{O^2}{^ - _3}$
(ख) हीरा तथा
(ग) ग्रेफाइट में कार्बन की संकरण-अवस्था क्या होती है?
उत्तर:
(क) $s{p^2}$
(ख) $s{p^3}$
(ग) $s{p^2}$
12. संरचना के आधार पर हीरा तथा ग्रेफाइट के गुणों में निहित भिन्नता को समझाइए।
उत्तर:
हीरा | ग्रेफाइट |
हीरे में क्रिस्टलीय जालक होता है।इसमें एक-दूसरे से बँधे कार्बन परमाणुओं का जाल होता है। | इसमें ग्रेफाइट में पर्ते 340 pm की दूरी पर पृथक्कृत रहती हैं। इन पर्तों के बीच यह अत्यधिक दूरी प्रदर्शित करती है कि केवल दुर्बल वाण्डरवाल्स बल इन पर्तों को बाँधे रखते हैं। |
प्रत्येक कार्बन परमाणु $sp_3$ संकरित होता है तथा एकल सहसंयोजी बन्ध द्वारा चार कार्बन परमाणुओं से जुड़ा रहता है। | ग्रेफाइट में, प्रत्येक कार्बन परमाणु sp2 संकरण तीन अन्य कार्बन परमाणुओं से परमाणुओं से सहसंयोजी रूप से जुड़ा रहता है। |
प्रत्येक कार्बन परमाणु चतुष्फलक के केन्द्र स्थित होता है तथा अन्य कार्बन परमाणु चतुष्फलक के चारों कोनों पर स्थित होते हैं। | प्रत्येक कार्बन परमाणु में चौथा इलेक्ट्रॉन π -बन्ध बनाता है। अतः यह द्विविमीय षट्कोणीय वलय रखता है। |
C_C बन्ध लम्बाई 154 pm होती है।इसलिए हीरे में प्रबल सहसंयोजी बन्धों का त्रिविमीय जाल होता है। | C_C सहसंयोजी दूरी 142 pm होती है जो प्रबल बन्ध को व्यक्त करती है। इन वलयों की व्यवस्था पर्ते बनाती है। |
यह अत्यन्त कठोर होता है। इसका गलनांक उच्च होता है। | यह अत्यन्त कोमल होता है। इसे मशीनों में शुष्क स्नेहक की भाँति प्रयोग किया जा सकता है। |
13. निम्नलिखित कथनों को युक्तिसंगत कीजिए तथा रासायनिक समीकरण दीजिए-
(ख) लेड क्लोराइड ऊष्मा के प्रति अत्यधिक अस्थायी है।
(क) लेड क्लोराइड $C{l_{2\,}}\,$से क्रिया करके $PbC{l_4}$देता है।
(ग) लेड एक आयोडाइड $PbC{l_4}$नहीं बनाता है|
उत्तर:
(क) लेड क्लोराइड, $PbC{l_{2\,}}\,$ क्लोरीन से क्रिया करके $PbC{l_4}$नहीं बनाती है। इसका कारण यह है कि अक्रिय युग्म प्रभाव के कारण $Pb$ की +2 ऑक्सीकरण अवस्था +4 ऑक्सीकरण अवस्था से अधिक स्थायी होती है। दूसरे शब्दों में, PbCl2, $PbC{l_4}$ से अधिक स्थायी है।
(ख) अक्रिय युग्म प्रभाव के कारण, $Pb$ की +4 ऑक्सीकरण अवस्था +2 ऑक्सीकरण अवस्था से कम स्थायी है। इस कारण लेड क्लोराइड गर्म करने पर विघटित होकर अधिक स्थायी लेड क्लोराइड बनाता है।
$PbCl{}_{4\,}\xrightarrow{\blacktriangle }PbC{l_2} + C{l_2} \uparrow $
(ग) $Pbl{}_{4\,}$ का अस्तित्व ज्ञात नहीं है। इसका कारण $P{h^{4 + }}$ की ऑक्सीकरण प्रकृति और I की अपचायक प्रकृति का संयुक्त प्रभाव है।
14. $B{F^3}$ में तथा $BF - 4$ में बन्ध लम्बाई क्रमशः 130 pm तथा 143 pm होने के कारण बताइए।
उत्तर:$B{F^3}$ अणु-में $\rho m - \rho r$back bonding के कारण B—F आबन्ध की लम्बाई को कम कर देते। हैं। $BF - 4$ में $B - F$ बन्ध शुद्ध एकल आबन्ध होता है और इसकी आबन्ध लम्बाई अधिक होती है। इसी कारण $B{F^3}$ में $B - F$आबन्ध लम्बाई $BF - 4$ से कम होती है।
15. $B - Cl$ आबन्ध द्विध्रुव आघूर्ण रखता है, किन्तु $BC{l_3}$ अणु का द्विध्रुव आघूर्ण शून्य होता है। क्यों?
उत्तर: बोरॉन की विद्युत ऋणात्मकता 2, जबकि $Cl$की 3 होती है। विद्युत ऋणात्मक में अन्तर के कारण, $B - Cl$बन्ध पोलर हो जाता है और निश्चित द्विध्रुव आघूर्ण रखता है। $BC{l_3}$ अणु में B परमाणु के sp2 संकरित होने के कारण यह एक त्रिकोणीय समतलीय अणु है। $BC{l_3}$ में तीन $B - Cl$बन्ध 120° पर एक ही तल में होते हैं। इसलिए दो $B - Cl$बन्धों के द्विध्रुव आघूर्ण का परिमाण तीसरे $B - Cl$ बन्ध के द्विध्रुव आघूर्ण के परिमाण के बराबर तथा विपरीत दिशा में होता है। परिणामस्वरूप $BC{l_3}$का शुद्ध द्विध्रुव आघूर्ण शून्य हो जाता है|
16. निर्जलीय $HF$ में ऐलुमिनियम ट्राइफ्लुओराइड अविलेय है, परन्तु $NaF$ मिलाने पर घुल जाता है। गैसीय $B{F_3}$ को प्रवाहित करने पर परिणामी विलयन में से ऐलुमिनियम ट्राइफ्लुओराइडे अवक्षेपित हो जाता है। इसका कारण बताइए।
उत्तर:$Al{F_3}$ निर्जलीय $HF$ में नहीं घुलता क्योंकि $HF$एक सहसंयोजक और प्रबल रूप से हाइड्रोजन आबन्ध युक्त यौगिक है। $NaF$ एक आयनिक यौगिक और $F - $आयन देता है जो $Al{F_3}$ से संयुक्त होकर जल में विलेय जटिल यौगिर्क $Na{}_3Al{F_6}$ का निर्माण करता है। इसलिए $Al{F_3}$, $NaF$ की उपस्थिति में घुल जाता है।
$3NaF + Al{F_3} \to Na{}_3\left[ {Al{F_6}} \right]$
जब परिणामी विलयन में BF3 गैस प्रवाहित की जाती है तो B (बोरॉन) अपने छोटे आकार और उच्च विद्युत ऋणात्मकता के कारण $Na{}_3\left[ {Al{F_6}} \right]$ में प्रवेश कर जाता है और$Al$ को निष्कासित कर देता है। इसलिए $Al{F_3}$ अवक्षेपित हो जाता है।
$Na{}_3\left[ {Al{F_6}} \right] + 3B{F_3} \to 3Na\left[ {B{F_4}} \right] + Al{F_3}$$ \downarrow $
17. $CO$ के विषैली होने का एक कारण बताइए।
उत्तर: रक्त में उपस्थित हीमोग्लोबिन शरीर के ऊतकों को O2, पहुँचाने का कार्य करता है। CO का रक्त में उपस्थित हीमोग्लोबिन के साथ जुड़कर कार्बोक्सीहीमोग्लोबिन बनाती है जो ऑक्सीहीमोग्लोबिन से 300 गुना अधिक स्थिर है। यह शरीर के विभिन्न अंगों में हीमोग्लोबिन की O2 वाहक क्षमता को समाप्त कर देता है। फलस्वरूप ऑक्सीजन की कमी के कारण व्यक्ति की मृत्यु हो जाती है।
$Haemoglobin + CO \to Carboxyhaemoglobin$
300 times more stable than oxyhaemoglobin
18. $C{O_2}$ की अधिक मात्रा भूमण्डलीय तापवृद्धि के लिए उत्तरदायी कैसे है?
उत्तर: $C{O_2}$ चक्र के कारण प्राकृतिक रूप से वातावरण में $C{O_2}$ की सान्द्रता स्थिर रहती है लेकिन, जब वातावरण में $C{O_2}$ की सान्द्रता मानवीय क्रियाओं के कारण एक निश्चित स्तर से अधिक हो जाती है, तो वायुमण्डल में उपस्थित $C{O_2}$ का आधिक्य पृथ्वी द्वारा विकरणित ऊष्मा को अवशोषित कर लेता है। अवशोषित ऊष्मा का कुछ भाग वायुमण्डल में निस्तारित हो जाता है और शेष भाग पृथ्वी पर वापस विकरणित हो जाता है जिससे पृथ्वी की सतह का तापमान बढ़ जाता है और भूमण्डलीय ताप में वृद्धि होती है। इस प्रभाव को ग्रीन हाउस प्रभाव कहा जाता है।
$\text { डाइबोरेन }\left(\mathrm{B}_{2} \mathrm{H}_{6}\right) \text { की संरचना }$
डाइबोरेन में बन्धन। डाइबोरेन में प्रत्येक बोरॉन परमाणु $s p^{3}$-संकरित होता है। इन चार $s p^{3}$-संकरित कक्षकों में से एक इलेक्ट्रॉनरहित होता है जिसे बिन्दुकृत रेखाओं द्वारा दर्शाया गया है। सिरे वाले $B-H$ सामान्य द्विकेन्द्रीय-द्विइलेक्ट्रॉन $(2 e-2 e)$ बन्ध हैं, जबकि दो सेतुबन्ध $B-H-B$ त्रिकेन्द्रीय-द्विइलेक्ट्रॉन $(3 \mathrm{c}-2 \theta)$ है। इसे 'केलाबन्ध भी कहते हैं।
(ख) बोरिक अम्ल की संरचना -
ठोस अवस्था में, बोरिक अम्ल की पर्तीय संरचना होती है, जहाँ समतलीय $B{O_5}$ की इकाइयाँ हाइड्रोजन बन्ध द्वारा एक-दूसरे से 318$pm$ की दूरी पर जुड़ी रहती हैं|
20. क्या होता है, जब?
(क) बोरेक्स को अधिक गर्म किया जाता है।
(ख) बोरिक अम्ल को जल में मिलाया जाता है।
(ग) ऐलुमिनियम की तनु $NaOH$ से अभिक्रिया कराई जाती है।
(घ) $B{F_{{}_3}}$ की क्रिया अमोनिया से की जाती है।
उत्तर:
1) जब बोरेक्स के चूर्ण को बुन्सन बर्नर की ज्वाला में अधिक गर्म किया जाता है, सर्वप्रथम यह जल के अणु का निष्कासन कर्के फूल जाता है। पुनः गर्म करने पर यह एक पारदर्शी द्रव में परिवर्तित हो जाता है, जो काँच के समान एक ठोस में परिवर्तित हो जाता है। इसे बोरेक्स मनका कहते हैं|
$Na2B4{O_7}.10{H_2}O\xrightarrow{\vartriangle }N{a_2}B{}_4O{}_{_7}\xrightarrow{\vartriangle }2NaB{O_2} + {B_2}{O_3}$
2) यह जल में घुल जाता है; क्योंकि यह इलेक्ट्रॉन-न्यून यौगिक है।
$B{\left( {OH} \right)_3} + H - OH \to {\left[ {B{{\left( {OH} \right)}_4}} \right]^{ - \,}} + {H^ + }$
(ग) ऐलुमिनियम $NaOH$ विलयन में घुलकर एक विलेय संकुल बनाता है तथा हाइड्रोजन गैस मुक्त करता है।
$2Al\left( s \right) + 2NaOH\left( {aq} \right) + 6{H_2}O \to 2N{a^ + }{\left[ {Al{{\left( {OH} \right)}_4}} \right]^ - }\left( {aq} \right) + 3{H_2}\left( g \right)$
(घ) $BF$ (व्यवहार में लूइस अम्ल) $N{H_3}$ (व्यवहार में लूइस-क्षारक) के साथ योगात्मक यौगिक बनाता है।
$B{F_3} + N{H_3} \to \left[ {{F_3}B \leftarrow N{H_3}} \right]$
21. निम्नलिखित अभिक्रियाओं को समझाइए-
(क) कॉपर की उपस्थिति में उच्च ताप पर सिलिकन को मेथिल क्लोराइड के साथ गर्म किया जाता है।
(ख) सिलिकन डाइऑक्साइड की क्रिया हाइड्रोजन फ्लुओराइड के साथ की जाती है।
(ग) C0 को Zn0 के साथ गर्म किया जाता है।
(घ) जलीय ऐलुमिना की क्रिया जलीय NaOH के साथ की जाती है।
उत्तर:
1) जब सिलिकन को मेथिल क्लोराइड के साथ उच्च ताप पर Cu की उपस्थिति में गर्म किया जाता है, तो मोनो, डाइ तथा ट्राइमिथाइलक्लोरोसाइलेन और थोड़ी मात्रा में टेट्रामिथाइलक्लोरोसाइलेन युक्त एक मिश्रण प्राप्त होता है।
$C{H_3}Cl + Si\xrightarrow[{573K}]{{Cu\,powder}}CH{}_3SiC{l_3} + \left( {C{H_3}} \right)2SiC{l_{\text{2}}} + {\left( {C{H_3}} \right)_4}Si$
2) जब $Si{O_2}$ की क्रिया $HF$ से की जाती है तो सिलिकॉन टेट्राक्लोराइड बनता है, जो $HF$ में घुलकर हाइड्रोफ्लोरो सिलिसिक अम्ल बनाता है।
$Si{O_2} + 4HF \to Si{F_4} + 2H_2^{}O$
$Si{F_4} + 2HF \to {H_2}Si{F_6}$
3) जब कार्बन मोनोऑक्साइड को जिंक ऑक्साइड के साथ गर्म किया जाता है, तो ZnO अपचयित होकर जिंक धातु बनाता है।
$CO + ZnO\xrightarrow{\vartriangle }Zn + C{O_2}$
4) जब जलयोजित ऐलुमिना को NaOH के जलीय विलयन के साथ गर्म किया जाता है तो सोडियम टेट्राहाइड्रॉक्सी ऐलुमिनेट (III) बनता है।
$Al{}_2{O_3}.2{H_2}O\left( s \right) + 2NaOH\left( {aq} \right) + {H_2}O\left( l \right)\xrightarrow{\vartriangle }2Na\left[ {Al{{\left( {OH} \right)}_4}} \right]aq$
22. कारण बताइए
(क) सान्द्र $HN{O_3}$ का परिवहन ऐलुमिनियम के पात्र द्वारा किया जा सकता है।
उत्तर: सान्द्र $HN{O_3}$ ऐलुमिनियम ($Al$) से क्रिया करके इसकी सतह पर ऐलुमिनियम ऑक्साइड की एक पतली परत बनाता है जो $Al$ की सान्द्र $HN{O_3}$से पुन: क्रिया को रोकती है। दूसरे शब्दों में, $Al$ सान्द्र $HN{O_3}$ के प्रभाव से निष्क्रिय हो जाता है।
$2Al\left( s \right) + 6HN{O_3} \to A{l_2}{O_3}\left( s \right) + 6N{O_2}\left( g \right) + 3{H_2}O\left( l \right)$
अतः सान्द्र $HN{O_3}$ के परिवहन में $Al$ कन्टेनर का उपयोग किया जाता है।
(ख) तनु $NaOH$तथा ऐलुमिनियम के टुकड़ों के मिश्रण का प्रयोग प्रवाहिका खोलने के लिए किया जाता है।
उत्तर: $Al$ तनु $NaOH$ से क्रिया करने पर हाइड्रोजन मुक्त करता है। इस प्रकार उच्च दाब पर विमुक्त $H$ , का उपयोग बन्द नालियों को खोलने में किया जा सकता है।
$2Al\left( s \right) + 2NAOH\left( {aq} \right) + 6{H_2}O \to 2Na + \left[ {Al{{\left( {OH} \right)}_4}} \right]\left( {aq} \right) + 3{H_2}\left( g \right)$
(ग) ग्रेफाइट शुष्क स्नेहक के रूप में प्रयुक्त होता है।
उत्तर: ग्रेफाइट की संरचना एक परतीय संरचना होती है जिसमें षटकोणीय वलय की विशाल परतें एक-दूसरे से दुर्बल वाण्डर वाल्स बलों द्वारा सम्बन्धित होती हैं। ये परतें एक-दूसरे से स्थायी रूप से नहीं जुड़ी होती हैं और एक-दूसरे पर फिसलती रहती हैं। यही कारण है कि ग्रेफाइट मुलायम होता है और एक शुष्क स्नेहक की भाँति प्रयोग किया जाता है।
(घ) हीरा का प्रयोग अपघर्षक के रूप में होता है।
उत्तर: हीरे की संरचना एक त्रिविमीय नेटवर्क संरचना है जिसमें sp संकरित कार्बन परमाणु एक-दूसरे से मजबूत सहसंयोजक आबन्धों द्वारा जुड़े रहते हैं। इसका नेटवर्क बहुत कठोर होता है। यही कारण है कि हीरा अत्यधिक कठोर होता है और इसका उपयोग एक अपघर्षक के रूप में किया जाता है।
(ङ) वायुयान बनाने में ऐलुमिनियम मिश्रधातु का उपयोग होता है।
उत्तर: ऐलुमिनियम की मिश्र धातुएँ हल्की होती हैं और ये अत्यन्त मजबूत एवं क्षय प्रतिरोधी होती हैं। इसलिए इनका उपयोग हवाई जहाजों को बनाने में किया जाता है।
(च) जल को ऐलुमिनियम पात्र में पूरी रात नहीं रखना चाहिए।
उत्तर: ऐलुमिनियम जल से तथा घुलित ऑक्सीजन से क्रिया कर अपनी सतह पर ऐलुमिनियम ऑक्साइड की एक पर्त बनाता है।
$2Al\left( s \right) + {O_2}\left( g \right) + {H_2}O\left( l \right) \to \,A{l_2}{O_3}\left( s \right) + {H_2}\left( g \right)$
इस परत में स्थित कुछ $A{l^{3 + }}$ आयन पानी में घुलकर एक विलयन बनाते हैं। $A{l^{3 + }}$ आयन विषैला होता है और पीने के पानी व खाने के पदार्थों में इसकी उपस्थिति अवांछित है
(छ) संचरण केबल बनाने में ऐलुमिनियम तार का प्रयोग होता है।
उत्तर: ऐलुमिनियम विद्युत धारा का अच्छा चालक है। भारानुसार यह $\,Cu$ की तुलना में दो गुनी अधिक विद्युत धारा को संचालित कर सकता है। $Al$ के तार हल्के और सस्ते होते हैं। इसलिए $Al$ का उपयोग संचरण केबिल बनाने में किया जाता है।
23. कार्बन से सिलिकॉन तक आयनीकरण एन्थैल्पी में प्रघटनीय कमी होती है। क्यों?
उत्तर: कार्बन से सिलिकॉन तक आयनीकरण में प्रघटनीय कमी होती है; क्योंकि कार्बन की परमाणु त्रिज्या (77$pm$ ) की तुलना में सिलिकॉन की परमाणु त्रिज्या अधिक (118$pm$) होती है। इसलिए इलेक्ट्रॉनों का निष्कासन सरलतापूर्वक हो जाता है। सिलिकॉन से जर्मेनियम तक आयनन एन्थैल्पी में कमी प्रघटनीय नहीं होती; क्योंकि तत्वों के परमाणु आकार एकसमान रूप से बढ़ते हैं।
24. $Al$ की तुलना में $Ga$ की कम परमाण्वीय त्रिज्या को आप कैसे समझाएँगे?
उत्तर: ऐलुमिनियम ($Al$) की तुलना में $Ga$ की कम परमाण्वीय त्रिज्या को प्रथम संक्रमण श्रेणी ($\,Z$=21 से 30) के दस तत्वों की उपस्थिति के आधार पर समझाया जा सकता है। इनमें इलेक्ट्रॉन 3$d$-कक्षकों में होते हैं। चूँकि 4-कक्षकों का आकार $d$-कक्षकों की तुलना में अधिक होता है; अत: अन्तरस्थ इलेक्ट्रॉनों के पास नाभिकीय आवेश में वृद्धि के प्रभाव को निरस्त करने के लिए पर्याप्त परिरक्षण प्रभाव नहीं होता। इसलिए $Ga$ की स्थिति में प्रभावी नाभिकीय आवेश का मान कम होता है। इससे अपवादस्वरूप $Ga$ का परमाणु आकार घट जाता है जिसे वास्तव में बढ़ा होना चाहिए था।
25. अपररूप क्या होता है? कार्बन के दो महत्त्वपूर्ण अपररूप हीरा तथा ग्रेफाइट की संरचना का चित्र बनाइए। इन दोनों अपरूपोंक्षे,भौतिक गुणों पर संरचना का क्या प्रभाव पड़ता, है?
उत्तर: अपररूप
प्रकृति में शुद्ध कार्बन दो रूपों में पाया जाता है-हीरा तथा ग्रेफाइट। यदि हीरे अथवा ग्रेफाइट को वायु में अत्यधिक गर्म किया जाए तो यह पूर्ण रूप से जल जाते हैं तथा कार्बन डाइऑक्साइड बनाते हैं। जब हीरे तथा ग्रेफाइट की समान मात्रा दहन की जाती है, तब कार्बन डाइऑक्साइड की बराबर मात्रा उत्पन्न होती है तथा कोई अवशेष नहीं बचता। इन तथ्यों से स्पष्ट है कि ह्मस तथा ग्रेफाइट रासायनिक रूप से एकसमान हैं तथा केवल कार्बन परमाणुओं बने हैं। इनके नैतिक गुण अत्यधिक भिन्न होते हैं। अतः इस प्रकार के गुणों को प्रदर्शित करने वाले तत्वों को अपररूप कहते हैं।
हीरा
हीरा में क्रिस्टलीय जालक होता है। इसमें प्रत्येक परमाणु $s{p^3}$ संकरित होता है तथा चतुष्फलकीय ज्यामिति से अन्य चार कार्बन परमाणुओं से जुड़ा रहता है। इसमें कार्बन-कार्बन बन्ध लम्बाई 154 $pm$ होती है। कार्बन परमाणु दिक में दृढ़ त्रिविमीय जालक का निर्माण करते हैं। इस संरचना में सम्पूर्ण जालक में दिशात्मक सहसंयोजक बन्ध उपस्थित रहते हैं। इस प्रकार विस्तृत सहसंयोजक बन्धन को तोड़ना कठिन कार्य होता है। अत: हीरा पृथ्वी पर पाया जाने वाला सर्वाधिक कठोर पदार्थ है। इसका उपयोग धार तेज करने के लिए अपघर्षक के रूप में, रूपदा बनाने में तथा विद्युत-प्रकाश लैम्प में टंगस्टन तन्तु बनाने में होता है।
ग्रेफाइट
ग्रेफाइट की पर्तीय संरचना होती है। ये पर्ते वाण्डर वाल्स बल द्वारा जुड़ी रहती हैं। इस कारण ग्रेफाइट चिकना तथा मुलायम होता है। दो पर्तों के मध्य की दूरी 340 $pm$ होती है। प्रत्येक पर्त में कार्बन परमाणु षट्कोणीय वलय के रूप में व्यवस्थित होते हैं जिसमें CC बन्ध लम्बाई 141-5 $pm$ होती है। षट्कोणीय वलय में प्रत्येक कार्बन परमाणु $s{p^{2 - }}$ संकरित होता है। प्रत्येक कार्बन परमाणु तीन निकटवर्ती कार्बन परमाणुओं से तीन सिग्मा बन्ध बनाता है। इसका चौथा इलेक्ट्रॉन -बन्ध बनाता है। सम्पूर्ण पर्त में इलेक्ट्रॉन विस्थानीकृत। होते हैं। इलेक्ट्रॉन गतिशील होते हैं; अतः ग्रेफाइट विद्युत का सुचालक होता है। उच्च ताप पर जिन मशीनों में तेल का प्रयोग स्नेहक के रूप में नहीं हो सकता है, उनमें ग्रेफाइट शुष्क स्नेहक का कार्य करता है।
26. (क) निम्नलिखित ऑक्साइड को उदासीन, अम्लीय, क्षारीय तथा उभयधर्मी ऑक्साइड के रूप में वर्गीकृत कीजिए-
$CO,{B_2}{O_3},Si{O_2},A{l_2}{O_3},Pb{O_2},T{l_2}{O_3}$
(ख) इनकी प्रकृति को दर्शाने वाली रासायनिक अभिक्रिया लिखिए।
उत्तर :
1) उदासीन ऑक्साइड : $CO$
2) अम्लीय ऑक्साइड : ${B_2}{O_3},Si{O_2}$,$C{O_2}$
3) उभयधर्मी ऑक्साइड : $A{l_2}{O_3},Pb{O_2}$
4) क्षारीय ऑक्साइड : $T{l_2}{O_3}$
i) अम्लीय ऑक्साइडों की क्षारों के साथ अभिक्रिया-
${B_2}{O_3} + 2NaOH \to 2NaB{O_2} + {H_2}O$
सोडियम मेटाबोरेट
$Si{O_2} + 2NaOH \to N{a_2}Si{O_3} + {H_2}O$
सोडियम सिलिकेट
$CO_2 + 2NaOH \to 2N{a_2}C{O_3} + {H_2}O$
ii) उभयधर्मी ऑक्साइडों की अम्लों व क्षारों के साथ अभिक्रिया-
$ A{l_2}{O_3} + 3{H_2}OS{O_4} \to A{l_2}{\left( {S{O_4}} \right)_3} + 3{H_2}O$
$A{l_2}{O_3} + 2NaOH \to 2NaAl{O_2} + {H_2}O$
$Pb{O_2} + 2HN{O_3} \to Pb{\left( {N{O_3}} \right)_2} + {H_2}O + \dfrac{1}{2}{O_2}$
$Pb{O_2} + 2NaOH \to N{a_2}Pb{O_3} + {H_2}O$
iii) क्षारीय ऑक्साइड की अम्ल के साथ अभिक्रिया-
$T{i_2}{O_3} + 3{H_2}S{O_4} + 4{H_2}O \to T{i_2}{\left( {S{O_4}} \right)_3}.7{H_2}O$
27. कुछ अभिक्रियाओं में थैलियम, ऐलुमिनियम से समानता दर्शाता है, जबकि अन्य में यह समूह-I के धातुओं से समानता दर्शाता है। इस तथ्य को कुछ प्रमाणों के द्वारा सिद्धे करें।
उत्तर: ऐलुमिनियम के समाने, थैलियम$T{l_2}{O_3}$, $TlC{l_3},\,T{l_2}{\left( {S{O_4}} \right)_3}$ आदि में +3 ऑक्सीकरण अवस्था प्रदर्शित करता है। Al तथा Tl के जटिल यौगिक भी समान प्रकार के होते हैं। जैसे– ${\left[ {Al{F_6}} \right]^{3 - }}$तथा ${\left[ {Tl{F_6}} \right]^{3 - }}$
अक्रिय युग्म प्रभाव के कारण यह समूह 1 ग्रुप की क्षार धातुओं के समान +1 ऑक्सीकरण अवस्था भी प्रदर्शित करता है। +1 ऑक्सीकरण अवस्था में यह $T{l_2}O,\,TlCl$ आदि यौगिकों का निर्माण करता है जो $N{a_2}O,\,NaCl$ आदि यौगिकों के समान है।$T{l_2}O$,$N{a_2}O$ के समान प्रबल क्षार हैं। अत: यह समूह 1 की धातुओं से भी समानता प्रदर्शित करता है।
28. जब धातु X की क्रिया सोडियम हाइड्रॉक्साइड के साथ की जाती है तो श्वेत अवक्षेप $\left( A \right)$प्राप्त होता है, जो $\,NaOH$ के आधिक्य में विलेय होकर विलेय संकुल (B) बनाता है। यौगिक $\left( A \right)$तनु $HCl$ में घुलकर यौगिक $\left( C \right)$ बनाता है। यौगिक $\left( A \right)$ को अधिक गर्म किए जाने पर यौगिक $\left( D \right)$ बनता है, जो एक निष्कर्षित धातु के रूप में प्रयुक्त होता है। $X,A,B,C\,$ तथा $D$ को पहचानिए तथा इनकी पहचान के समर्थन में उपयुक्त समीकरण दीजिए।
उत्तर: दी गई अभिक्रियाएँ प्रदर्शित करती हैं कि धातु $X$ ऐलुमिनियम है। अभिक्रियाओं को निम्न प्रकार लिखा जा सकता है-
$2Al\left( s \right) + 3NaOH\left( {aq} \right) \to Al{\left( {OH} \right)_3} + N{a^ + }\left( {aq} \right)$
$\left( X \right)$ एलम हाइड्रोऑक्साइड
$Al{\left( {OH} \right)_3}\left( s \right) + NaOH\left( {aq} \right) \to Na{\left[ {Al{{\left( {OH} \right)}_4}} \right]^ - }\left( {aq} \right)$
$\left( A \right)$ सोडियम टेट्रा हाइड्रोओक्सोएलुमिनेट$\left( {III} \right)$
$\left( B \right)$
$Al{\left( {OH} \right)_3} + HCl\left( {aq} \right) \to AlC{l_3}\left( {aq} \right) + 3{H_2}O$
एल्युमीनियम क्लोराइड
$\left( C \right)$
$Al{\left( {OH} \right)_3}\left( s \right)\xrightarrow{\vartriangle }A{l_2}{O_3}\left( A \right) + 3{H_2}O$
$\left( A \right)$ एलुमिना
$\left( D \right)$
अतः $\left[ X \right] = Al,\left[ A \right] = Al{\left( {OH} \right)_3},\left[ B \right] = N{a^ + }{\left[ {Al{{\left( {OH} \right)}_4}} \right]^ - },\left[ C \right] = AlC{l_3}$और $\left[ D \right]\, = A{l_2}{O_3}$
29. निम्नलिखित से आप क्या समझते हैं?
(क) अक्रिय युग्म प्रभाव
उत्तर: अक्रिय युग्म प्रभाव- कोश इलेक्ट्रॉनिक विन्यास, $\left( {n - 1} \right){d^{10}}n{s^2}n{p^1}$वाले तत्व में, 4-कक्षक के इलेक्ट्रॉन दुर्बल परिरक्षण प्रभाव प्रस्तावित करते हैं। इसलिए $n{s^2}$ इलेक्ट्रॉन नाभिक के धनावेश द्वारा अधिक दृढ़ता से बँधे रहते हैं। इस प्रबल आकर्षण के परिणामस्वरूप, $ns$ इलेक्ट्रॉन युग्मित रहते हैं तथा बन्ध में भाग नहीं लेते हैं अर्थात् अक्रिय रहते हैं। यह प्रभाव अक्रिय युग्म प्रभाव कहलाता है। इस स्थिति में, $n{s^2}n{p^1}$विन्यास में, तीन इलेक्ट्रॉनों में से केवल एक इलेक्ट्रॉन बन्ध-निर्माण में भाग लेता है।
(ख) अपररूप
उत्तर: अपररूप- किसी तत्व का समान रासायनिक अवस्था में दो या अधिक भिन्न-रूपों में पाया जाना अपररूपता कहलाता है। तत्व के ये विभिन्न रूप अपररूप किसी तत्व के सभी अपररूपों के समान रासायनिक गुण होते हैं, परन्तु इनके भौतिक गुणों में अन्तर होता है।
(ग) श्रृंखलन
उत्तर: श्रृंखलन- कार्बन में अन्य परमाणुओं के साथ सहसंयोजक बन्ध द्वारा जुड़कर लम्बी श्रृंखला या वलय बनाने की प्रवृत्ति होती है। इस प्रवृत्ति को श्रृंखलन कहते हैं। $C - C$ बन्ध अधिक प्रबल होने के कारण ऐसा होता है।
30. एक लवण x निम्नलिखित परिणाम देता है
(क) इसका जलीय विलयन लिटमस के प्रति क्षारीय होता है।
उत्तर: चूंकि दिये गये लवण का जलीय विलयन लिटमस के प्रति क्षारीय है तो यह सुनिश्चित है कि यह प्रबल क्षार और दुर्बल अम्ल से मिलकर बना लवण है।
(ख) तीव्र गर्म किए जाने पर यह काँच के समान ठोस में स्वेदित हो जाता है।
उत्तर: लवण $\left[ X \right]$ गर्म करने पर फूल जाता है और काँच जैसे पदार्थ में परिवर्तित हो जाता है। इसलिए $\left[ X \right]$ को बोरेक्स और $\left[ Y \right]$ को सोडियम मेटाबोरेट और बोरिक ऐनहाइड्राइड का मिश्रण होना चाहिए।
(ग) जब $X$ के गर्म विलयन में सान्द्र ${H_2}S{O_4}$ मिलाया जाता है तो एक अम्ल $Z$ का श्वेत क्रिस्टल बनता है। उपर्युक्त अभिक्रियाओं के समीकरण लिखिए और $X$, $Y$तथा $Z$ को पहचानिए।
उत्तर: जब बोरेक्सा $\left[ X \right]$ के गर्म विलयन में सान्द्र ${H_2}S{O_4}$ मिलाया जाता है, तो ऑथ्रो बोरिक अम्ल [2] के सफेद क्रिस्टल प्राप्त होते हैं।
अतः, $\left[ X \right] = N{a_2}{B_4}{O_7}.10{H_2}O,\,\left[ Y \right] = NaB{O_2} + {B_2}{O_3}\,$और $\left[ 2 \right] = {H_3}\,B{O_3}$
अभिक्रियाओं को निम्न प्रकार लिखा जा सकता है-
$N{a_2}{B_4}{O_7}.10{H_2}O\xrightarrow[{Water\,hyrolysis}]{{Water}}2NaOH + {H_3}\,{B_4}{O_7}\,\, + 8{H_2}O$
बोरेक्स एल्कलाइन सलूशन
$N{a_2}{B_4}{O_7}.10{H_2}O\xrightarrow[{}]{\vartriangle }N{a_2}{B_4}{O_7}\xrightarrow{\vartriangle }2NaB{O_2} + \,{B_2}{O_3}\,\,$
बोरेक्स एनहायद्रस बोरेक्स सोडियम मेटाबोरेट बोरिक एनहायद्रिड ग्लासी मटेरियल
31. सन्तुलित समीकरण दीजिए-
(क) ${B_2}{H_6} + 6{H_2}O \to 2{H_3}B{O_3} + 6{H_2}$
उत्तर: $2B{F_3} + 6LiH \to \,{B_2}{H_6} + 6LiF$ डाईबोरन
(ख) ${B_2}{H_6} + {H_2}O \to $
उत्तर: ${B_2}{H_6} + 6{H_2}O \to 2{H_3}B{O_3} + 6{H_2}$ ओर्थो बोरिक एसिड
(ग) $NaH + {B_2}{H_6} \to $
उत्तर: $2NAH + {B_2}{H_6} \to 2N{A^ + }{\left[ {BH4} \right]^ - }$ सोडियम बोरोहायडाईद
(घ) ${H_3}B{O_3}\xrightarrow{\vartriangle }$
उत्तर: $2{H_3}B{O_3}\xrightarrow{\vartriangle }2HB{O_2} + 2{H_2}O$ ओर्थोबोरिक एसिड मेटा बोरिक एसिड $4HB{O_2}\xrightarrow{\vartriangle }{H_2}B{}_4O{}_7 + H{}_2O$ टेट्राबोरिक एसिड ${H_2}B{}_4O{}_7\xrightarrow{\vartriangle }2{B_2}{O_3} + H{}_2O$ बोरिक एनहाईद्रिड
(ङ) $Al + NaOH \to $
उत्तर: $2Al + NaOH + 6{H_2}O \to 2Na{}^ + {\left[ {Al{{\left( {OH} \right)}_4}} \right]^ - } + 3{H_2}$ सोडियम टेट्राह्यद्रोक्सोएलुमिनेट(III)
(च) ${B_2}{H_6} + N{H_3} \to $
उत्तर: $3{B_2}{H_6} + 6N{H_3}\xrightarrow{\vartriangle }3{\left[ {B{H_2}{{\left( {N{H_3}} \right)}_2}} \right]^ - }{\left[ {BH_4^{}} \right]^ - }\xrightarrow{{HEAT}}2{B_3}{N_3}{H_6} + 12{H_2}$
32. $CO$ तथा $C{O_2}$ प्रत्येक के संश्लेषण के लिए एक प्रयोगशाला तथा एक औद्योगिक विधि दीजिए।
उत्तर:
कार्बन मोनोक्साइड- प्रयोगशाला विधि- सान्द्र सल्फ्यूरिक अम्ल का $373K$ पर फॉर्मिक अम्ल के द्वारा निर्जलीकरण कराने पर अल्प मात्रा में शुद्ध कार्बन मोनोक्साइड प्राप्त होती है।
$HCOOH\xrightarrow[{CON.{H_2}S{O_4}}]{{373K}}{H_2}O + CO \uparrow $
औद्योगिक विधि -औद्योगिक रूप से इसे कोक पर भाप प्रवाहित करके बनाया जाता है। इस प्रकार $CO$ तथा ${H_2}$ का प्राप्त मिश्रण ‘वाटर गैस’ अथवा ‘संश्लेषण गैस’कहलाता है।
$C\left( s \right) + {H_2}O\left( g \right)\xrightarrow{{473 - 1273K}}CO\left( g \right) + {H_2}\left( g \right)$(water gas) जब भाप के स्थान पर वायु का प्रयोग किया जाता है, तब $CO$ तथा ${N_2}$ का मिश्रण प्राप्त होता है। इसे प्रोड्यूसर गैस कहते हैं।
${C_{\left( s \right)}} + {O_2}_{\left( g \right)} + 4{N_2}\xrightarrow{{1273K}}2C{O_{\left( g \right)}} + 4{N_2}_{\left( g \right)}$ (प्रोडूसर गैस) कार्बन डाइऑक्साइड –
प्रयोगशाला विधि- प्रयोगशाला में इसे कैल्सियम कार्बोनेट पर तनु HCl की अभिक्रिया द्वारा बनाया जाता है।
$CaC{O_3}_{\left( s \right)} + 2HC{l_{\left( {aq} \right)}}\xrightarrow{{}}CaC{l_2}_{\left( {aq} \right)} + C{O_2}_{\left( g \right)} + {H_2}{O_{\left( l \right)}}$
औद्योगिक विधि- औद्योगिक रूप में चूना पत्थर को गर्म करके $C{O_2}$ बनाई जा सकती है।
$CaC{O_3}_{\left( s \right)}\xrightarrow{\vartriangle }CaO + C{O_2}_{\left( g \right)}$
33. बोरेक्स के जलीय विलयन की प्रकृति कौन-सी होती है?
(क) उदासीन
(ख) उभयधर्मी
(ग) क्षारीय
(घ) अम्लीय
उत्तर: ऐसा इसलिए है क्योंकि बोरेक्स प्रबल क्षार ($NaOH$) और दुर्बल अम्ल (${H_3}B{O_3}$) से बना लवण है। जल में, यह जल अपघटित होकर क्षारीय विलयन बनाता है।
34 . बोरिक अम्ल के बहुलकीय होने का कारण
(क) इसकी अम्लीय प्रकृति है।
(ख) इसमें हाइड्रोजन बन्धों की उपस्थिति है।
(ग) इसकी ऐकक्षारीय प्रकृति है।
(घ) इसकी ज्यामिति है।
उत्तर: (ख) इसमें हाइड्रोजन बन्धों की उपस्थिति है।।
35. डाइबोरेन में बोरॉन का संकरण कौन-सा होता है?
(क) $sp$
(ख) $s{p^2}$
(ग) $s{p^3}$
(घ) $ds{p^2}$
उत्तर: (ग) $s{p^3}$
36. ऊष्मागतिकीय रूप से कार्बन का सर्वाधिक स्थायी रूप कौन-सा है?
(क) हीरा
(ख) ग्रेफाइट
(ग) फुलरीन्स
(घ) कोयला
उत्तर: (ख) ग्रेफाइट
37. निम्नलिखित में से समूह-14 के तत्वों के लिए कौन-सा कथन सत्य है?
(क) +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
(ख) +2 तथा +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
(ग) ${M^{2 - }}$ तथा ${M^{4 + }}$ आयन बनाते हैं।
(घ) ${M^{2 + }}$ तथा ${M^{4 - }}$ आयन बनाते हैं।
उत्तर: (ख) +2 तथा +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
38. यदि सिलिकॉन निर्माण में प्रारम्भिक पदार्थ $RSiC{l_3}$ है तो बनने वाले उत्पाद की संरचना बताइए।
उत्तर: यदि अभिक्रिया में प्रारम्भिक पदार्थ $RSiC{l_3}$ है तो अन्तिम उत्पाद एक क्रॉस लिन्कड सिलिकॉन होगा, जैसा कि निम्न से स्पष्ट है- यदि अभिक्रिया में प्रारम्भिक पदार्थ $RSiC{l_3}$ है तो अन्तिम उत्पाद एक क्रॉस लिन्कड सिलिकॉन होगा, जैसा कि निम्न से स्पष्ट है-
NCERT Solutions for Class 11 Chemistry Chapter 5 The p-Block Elements in Hindi
Chapter-wise NCERT Solutions are provided everywhere on the internet with an aim to help the students to gain a comprehensive understanding. Class 11 Chemistry Chapter 11 solution Hindi mediums are created by our in-house experts keeping the understanding ability of all types of candidates in mind. NCERT textbooks and solutions are built to give a strong foundation to every concept. These NCERT Solutions for Class 11 Chemistry Chapter 11 in Hindi ensure a smooth understanding of all the concepts including the advanced concepts covered in the textbook.
NCERT Solutions for Class 11 Chemistry Chapter 11 in Hindi medium PDF download are easily available on our official website (vedantu.com). Upon visiting the website, you have to register on the website with your phone number and email address. Then you will be able to download all the study materials of your preference in a click. You can also download the Class 11 Chemistry The p-Block Elements solution Hindi medium from Vedantu app as well by following the similar procedures, but you have to download the app from Google play store before doing that.
NCERT Solutions in Hindi medium have been created keeping those students in mind who are studying in a Hindi medium school. These NCERT Solutions for Class 11 Chemistry The p-Block Elements in Hindi medium pdf download have innumerable benefits as these are created in simple and easy-to-understand language. The best feature of these solutions is a free download option. Students of Class 11 can download these solutions at any time as per their convenience for self-study purpose.
These solutions are nothing but a compilation of all the answers to the questions of the textbook exercises. The answers/ solutions are given in a stepwise format and very well researched by the subject matter experts who have relevant experience in this field. Relevant diagrams, graphs, illustrations are provided along with the answers wherever required. In nutshell, NCERT Solutions for Class 11 Chemistry in Hindi come really handy in exam preparation and quick revision as well prior to the final examinations.
FAQs on NCERT Solutions For Class 11 Chemistry in Hindi Chapter 11 The P-Block Elements (2025-26)
1. Where can I get the correct, step-by-step NCERT Solutions for Class 11 Chemistry Chapter 11 (The P-Block Elements)?
You can find clear and accurate NCERT Solutions for Class 11 Chemistry Chapter 11, The P-Block Elements, right here on Vedantu. Our solutions are created by subject experts and provide detailed, step-by-step explanations for every question in the textbook, all updated for the 2025-26 CBSE syllabus.
2. What is the best way to use these NCERT solutions for my exam preparation?
For effective preparation, first attempt to solve the chapter exercises yourself. Afterwards, use these solutions to verify your answers or to understand the correct method if you are stuck. Pay close attention to the problem-solving steps shown, as this will help you tackle similar questions in your exams with confidence.
3. Do the solutions for 'The P-Block Elements' cover all the important named compounds and their structures?
Yes, absolutely. The solutions cover all important compounds mentioned in the chapter, such as borax, boric acid, and diborane. For questions involving structures, the answers provide a clear, step-by-step method for drawing them correctly, including unique cases like the banana bonds in diborane.
4. How do these NCERT solutions help in understanding tricky concepts like the inert pair effect?
Our solutions go beyond just giving the final answer. When a question involves a concept like the inert pair effect, the answer explains the underlying principle—why heavier p-block elements prefer a lower oxidation state. This helps you understand the 'why' behind the trend, not just memorise it.
5. What common mistakes in solving problems about carbon's allotropes can I avoid with these solutions?
A common mistake is incorrectly explaining the difference in properties between diamond and graphite. The solutions guide you by linking structure to function. They clearly explain how graphite's layered structure makes it soft and a good conductor, while diamond's rigid network structure makes it extremely hard, helping you answer comparison questions accurately.
6. How can solving the exercises on Group 14 elements help me understand the real-world use of silicones?
By working through the NCERT questions with our solutions, you will understand the unique properties of silicones, such as their thermal stability and water-repellent nature. The answers connect these chemical properties to their practical applications as sealants, lubricants, and in water-proofing materials, making the topic more relatable.
7. Are the solutions for both the in-text questions and the end-of-chapter exercises for The P-Block Elements included?
Yes, our NCERT solutions are comprehensive. We provide detailed, step-by-step answers for all questions, including the in-text examples that appear throughout the chapter and all the problems listed in the final exercises. This ensures you have complete support for mastering the entire chapter.

























