NCERT Solutions For Class 10 Science Chapter 2 Acids, Bases And Salts in Hindi - 2025-26
NCERT Solutions For Class 10 Science In Hindi Chapter 2 Acids, Bases And Salts - 2025-26
FAQs on NCERT Solutions For Class 10 Science In Hindi Chapter 2 Acids, Bases And Salts - 2025-26
1. What is the correct explanation for why curd and other sour substances should not be kept in brass and copper vessels, as per NCERT Class 10 Chapter 2?
The correct explanation is based on a chemical reaction. Curd and other sour substances contain acids. These acids react with metals like brass and copper to form toxic metal compounds, such as copper salts. This process, known as corrosion, spoils the food and makes it harmful for consumption. Therefore, to prevent food poisoning and spoilage, acidic foods should be stored in non-reactive containers like glass or stainless steel.
2. According to the NCERT solution methodology, how does the pH of fresh milk change when it turns into curd?
Fresh milk is slightly acidic, with a pH of around 6. When it turns into curd, bacteria like Lactobacillus convert the lactose (milk sugar) into lactic acid. The formation of this acid increases the hydrogen ion (H+) concentration in the mixture. According to the pH scale concept, a higher concentration of H+ ions leads to a lower pH value. Thus, the pH of the curd will be significantly lower than 6, indicating it has become more acidic.
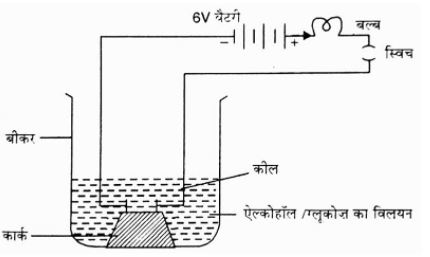
3. Why does dry HCl gas not change the colour of a dry litmus paper, but an aqueous solution of HCl does? What core concept does this NCERT problem demonstrate?
This phenomenon demonstrates a fundamental property of acids. An acid shows its acidic properties only in the presence of water. Dry HCl gas does not dissociate into ions. However, in an aqueous solution, HCl dissolves in water to release hydrogen ions (H⁺) or hydronium ions (H₃O⁺). These ions are responsible for changing the colour of blue litmus paper to red. Without the presence of water, there is no dissociation, and thus, no acidic behaviour is observed.
4. How should a student solve a problem involving a universal indicator showing different colours for three solutions, as per the CBSE pattern?
To solve this correctly, follow these steps:
- Step 1: Relate Colour to pH: Recall the colour chart for the universal indicator. Strong acids give a red colour (pH 0-2), weak acids give orange/yellow (pH 3-6), neutral solutions give green (pH 7), weak bases give blue (pH 8-11), and strong bases give violet/purple (pH 12-14).
- Step 2: Assign pH Range: Assign a probable pH range to each solution based on its colour. For example, red indicates a low pH, while blue indicates a higher, alkaline pH.
- Step 3: Arrange in Order: Arrange the solutions in increasing or decreasing order of their pH values based on the colour spectrum from red to violet. This directly reflects their strength from highly acidic to highly basic.
5. What is the step-by-step method to solve problems on the preparation of Plaster of Paris (POP) from gypsum?
The correct method involves understanding the role of water of crystallisation. The steps are:
- Step 1: Write the Balanced Equation: Start with the chemical equation for heating gypsum: CaSO₄·2H₂O (Gypsum) → CaSO₄·½H₂O (Plaster of Paris) + 1½H₂O (Water).
- Step 2: Understand the Reaction: Note that gypsum is calcium sulphate dihydrate and POP is calcium sulphate hemihydrate. The process involves carefully heating gypsum to 373 K (100°C) to lose exactly one and a half molecules of water.
- Step 3: Explain the Precaution: A crucial part of the solution is mentioning that if gypsum is heated above 373 K, it will lose all its water of crystallisation and turn into anhydrous calcium sulphate (CaSO₄), known as 'dead-burnt plaster,' which does not have setting properties.
6. How do the NCERT Solutions for Class 10 Science Chapter 2 assist in mastering the topic for board exams?
Vedantu's NCERT Solutions for this chapter offer comprehensive support by:
- Providing detailed, step-by-step answers for all in-text and exercise questions, making complex concepts easier to understand.
- Aligning with the latest CBSE 2025-26 syllabus and marking scheme, which helps students write answers that score maximum marks.
- Covering all essential topics, including the pH scale, chemical properties of acids and bases, and the preparation and uses of important salts like washing soda and Plaster of Paris.
7. What is the difference in the salt formed from a neutralisation reaction between a strong acid-strong base versus a strong acid-weak base?
The key difference lies in the pH of the resulting salt solution.
- When a strong acid (e.g., HCl) reacts with a strong base (e.g., NaOH), they completely neutralise each other, forming a neutral salt (e.g., NaCl) with a pH of exactly 7.
- When a strong acid (e.g., HCl) reacts with a weak base (e.g., NH₄OH), the resulting salt (e.g., NH₄Cl) is acidic in nature, with a pH less than 7, because the conjugate acid of the weak base hydrolyzes water to produce H⁺ ions.
8. How are washing soda and baking soda prepared according to the NCERT textbook?
The preparation methods outlined in the NCERT solutions are:
- Baking Soda (Sodium Hydrogen Carbonate, NaHCO₃): It is produced using the Solvay process. The reaction involves passing carbon dioxide gas through a cold, concentrated solution of sodium chloride (brine) saturated with ammonia. The chemical equation is: NaCl + H₂O + CO₂ + NH₃ → NH₄Cl + NaHCO₃.
- Washing Soda (Sodium Carbonate, Na₂CO₃·10H₂O): It is obtained in a two-step process. First, baking soda (NaHCO₃) is heated to produce anhydrous sodium carbonate (soda ash). Then, soda ash is dissolved in water and recrystallised to get washing soda, which contains 10 molecules of water of crystallisation.




















 Watch Video
Watch Video